Proč stárneme: aktuální stav vědeckého poznání

Zastavit stárnutí a uchovat si věčné mládí bylo lidským snem už od nepaměti
Krátká historie výzkumu stárnutí
Zastavit stárnutí a uchovat si věčné mládí bylo lidským snem už od nepaměti. Moderní věda, která mnohé sny dokázala realizovat, však až donedávna neměla nástroje, které by ji umožnily podívat se celému problému na zoubek. Místo toho zkoumala konkrétní projevy - nemoci kardiovaskulárního systému, zhoubných nádorů, cukrovky a dalších.
Článek vychází z knihy Konec stárnutí, kterou vám velmi doporučujeme. Prohlédnout si ji můžete tady.
Jak vnímá proces stárnutí dnešní věda
Od 50. let 20. století platila ve výzkumu stárnutí teorie oxidativního stresu, která říkala že volné radikály a oxidanty způsobují postupnou degradaci DNA, která vede k poruchám různých funkcí buněk. Bránit se volným radikálům bylo možné příjmem antioxidantů.
Ve 21. století jsme díky novým technologiím významně pokročili ve studii aspektů stárnutí a dnes již víme, že volné radikály nejsou jedinou a dokonce nejspíš ani hlavní příčinou. Některé studie dokonce ukazují, že volné radikály nemají na délku života vliv vůbec, s výjimkou extrémních případů jako je například kouření. Prozatím věda neobjevila jasnou příčinu, která by měla stárnutí na svědomí.
Moderní výsledky výzkumů (bavíme se o posledních 5-10 letech) ukazují, že stárnutí je proces kdy se v těle v průběhu času akumulují různá drobná poškození. Jejich přibývající množství se projeví přibývajícím množstvím onemocnění a neduhů, které v určitém okamžiku již tělo nezvládne a končí smrtí daného jedince. Je to podobné jako u auta - nový vůz funguje skvěle, s časem u něj začnou přibývat různé drobné i větší problémy a po určité době jich je tolik, že další opravy již nedokáží zachránit funkční celek.
Moderní vědecké teorie popisují různé aspekty stárnutí a místo hledání příčiny říkají, jak drobné poruchy v jedné oblasti ovlivňují fungování ostatních. Nejznámější se jmenuje “známky stárnutí” (hallmarks of aging) a popisuje na biochemické úrovni 9 symptomů spojených se stárnutím.
Vývoj v této oblasti je stále velmi bouřlivý a dá se předpokládat, že tato teorie bude i do budoucna upravována podle nejnovějších poznatků. Jeden takovýto krok proběhl v roce 2023, kdy bylo původních 9 symptomů rozšířeno na aktuálních 12.
V následujícím textu si oněch 12 známek přiblížíme a v dalších dílech seriálu se na ně odkážeme při popisu doporučení, jak stárnutí zpomalit.

Jaké jsou známky stárnutí
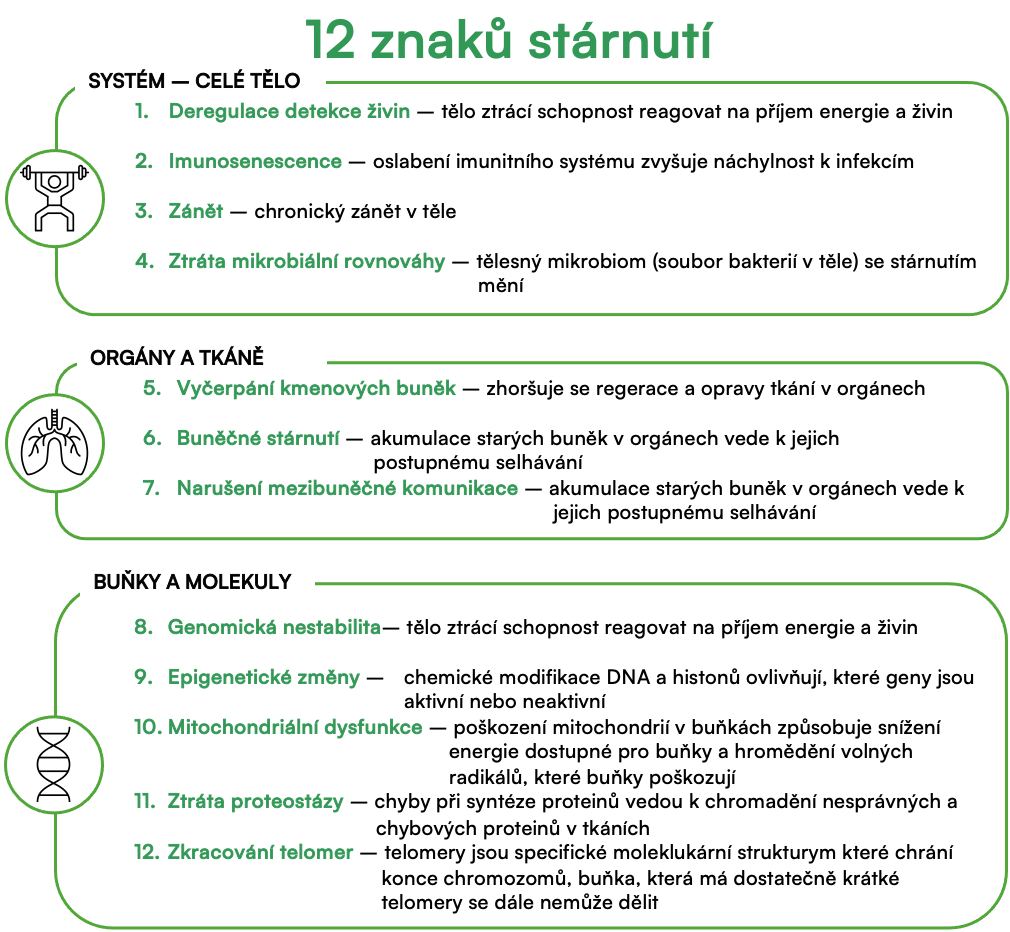
Nestabilita genomu
Správné fungování genomu je jedním z nejdůležitějších předpokladů pro hladké fungování buňky a celého organismu.
Změny v genetickém kódu byly dlouho považovány za jednu z hlavních příčin stárnutí. U mnohobuněčných organismů je nestálost genomu primární příčinou nádorových onemocnění a u lidí je také významnou příčinou vzniku některých neurodegenerativních chorob.
Poruchy v DNA vznikají zejména vlivem prostředí a oxidačního stresu. V těle taktéž existuje několik molekulárních procesů, které neustále pracují na opravě této škody. Bohužel, výsledky nejsou dokonalé a poškození se hromadí časem. Několik přehledových článků ukázalo, že nedostatečná oprava DNA, která umožňuje větší akumulaci poškození DNA, způsobuje předčasné stárnutí a tedy zvýšená oprava poškozeného DNA přispívá k delšímu životu.
Zkracování telomer
Telomery jsou oblasti opakujících se nukleotidových sekvencí na koncích lineárních chromozomů.
Chrání koncové oblasti chromozomové DNA před postupným rozkladem a brání tomu, aby opravné systémy rozeznaly konce DNA od poruchy.
Zkracování telomer je spojováno se stárnutím a souvisejícími chorobami. Normální stárnutí je spojováno se zkracováním telomerů jak u lidí, tak u myší, a studie na zvířecích modelech naznačují příčinnou souvislost. Při každém proběhnutí mitózy se telomery na koncích každého chromozomu mírně zkracují, a u lidských buněk dochází zpravidla k 40-60 rozdělením než se telomery zkrátí na kritickou délku. To je užitečné, když je třeba zastavit nekontrolované buněčné množení (jako np. u nádorových onemocnění), ale škodlivé, když se normálně fungující buňky nemohou dělit.
Enzym nazývaný telomeráza prodlužuje telomery v gametách a kmenových buňkách. Nedostatek telomerázy je u lidí spojován s výskytem nemocí souvisejících se stářím.
Epigenetické změny
Funkce genomu závisí nejen na pořadí konkrétních nukleotidů, ale i na tom, které úseky řetězce DNA jsou aktivní a připraveny k použití (transkripci), a které jsou naopak nedostupné. Existuje vícero mechanismů, které mohou použití genu ovlivnit: například navinutí/odvinutí genu na histonová jádra, modifikace histonových jader či navázání dodatečných molekul (methylace).
V závislosti na potřebách konkrétního tkáňového typu a prostředí, v němž se buňka nachází, mohou být histony modifikovány tak, aby zapínaly nebo vypínaly určité geny podle potřeby. Celý genom včetně modifikací zapínajících či vypínajících jednotlivé geny se nazývá epigenom. Profil, kde, kdy a do jaké míry tyto modifikace nastávají (epigenetický profil), se s věkem mění, což vede k vypínání užitečných genů a zapínání zbytečných, narušuje normální fungování buňky.
Konkrétním příkladem jsou sirtuiny. Jedná se o enzymy, které podporují vázání DNA na histony a tím vypínají zbytečné geny. Tyto enzymy používají NAD jako palivo pro své fungování. S věkem klesá úroveň NAD v našich buňkách a také schopnost sirtuinů vypínat nepotřebné geny v pravý čas. Snížení aktivity sirtuinů bylo spojeno s urychlením procesu stárnutí a zvýšení jejich aktivity vedlo k pozdějšímu nástupu nemocí spojených se stářím.
Ztráta proteostázy
Proteostáza je proces udržující všechny proteiny nezbytné pro fungování buňky v jejich správném tvaru, struktuře a množství.
Skládání proteinů, oxidace, abnormální štěpení nebo nežádoucí modifikace mohou vytvářet nefunkční, případně toxické proteiny, které brání normálnímu fungování buňky. V těle jsou tyto proteiny neustále odstraňovány a recyklovány, avšak s věkem se tvorba poškozených proteinů zvyšuje, což vede k postupné ztrátě proteostázy.
Studie naznačují, že tento proces lze zpomalit nebo potlačit buď omezením příjmu kalorií nebo podáváním látky rapamycin. V obou případech se jedná o inhibici molekuly mTOR, avšak na přesném mechanismu nepanuje ve vědeckých kruzích shoda.
Deregulovaná detekce živin
Vnímání živin je schopnost buňky rozpoznat a reagovat na změny koncentrace nutrientů, jako je glukóza, mastné kyseliny a aminokyseliny.
V době hojnosti je buňka nabádána ke stavění molekul (anabolism) prostřednictvím různých signálních molekul, z nichž nejlépe je prozkoumána mTOR. Když je energie a živiny omezeny, buňka to pomocí příslušných receptorů rozpozná a vypne mTOR, aby šetřila zdroje.
U rostoucího organismu jsou růst a buněčné dělení důležité, a proto je mTOR silně aktivovaný. U dospělého a stárnoucího organismu přirozeně klesají signály aktivující mTOR. Bylo zjištěno, že umělá zvýšení aktivace této molekuly u dospělých myší vede ke zrychlenému stárnutí a zvýšenému výskytu rakoviny. Metody potlačení aktivace mTOR, jako je omezování stravy nebo podávání rapamycinu, byly prokázány jako jedny z nejrobustnějších metod prodloužení životnosti u červů, much a myší.
Mitochondriální dysfunkce
Mitochondrie jsou energetickou továrnou buňky.
Různé lidské buňky obsahují od několika do 2500 mitochondrií, každá z nich přeměňuje uhlík a kyslík na energii (ve formě ATP) a oxid uhličitý.
Během stárnutí se účinnost mitochondrií snižuje. Příčiny nejsou stále zcela jasné, je zde však několik podezřelých mechanismů - snížená biogeneze, akumulace poškození a mutací v mitochondriální DNA, oxidace mitochondriálních proteinů a porucha kontroly kvality prostřednictvím mitofágie.
Dysfunkční mitochondrie pak narušují vnitrobuněčnou signalizaci a spouštějí zánětlivé reakce, čímž přispívají ke stárnutí.
Buněčné stárnutí (buněčná senescence)
Za normálních okolností buňky končí svou existenci naprogramovanou buněčnou smrtí - apoptózou. Při tomto procesu se buňka rozpadne na spoustu malých fragmentů, které pak mohou být uklizeny a dále zpracovány. V dospělém lidském těle podstoupí apoptózu 50-70 milionů buněk každý den.
V některých případech však buňka přestane plnit svou funkci, aniž by aktivovala apoptózu. Tento stav se nazývá buněčná senescence. Senescence může být způsobena několika faktory, np zkracováním telomerů, poškozením DNA a stresem. Imunitní systém je naprogramován tak, aby vyhledával a eliminovat senescentní buňky, avšak ne vždy se mu to podaří a s věkem se senescentní buňky v těle hromadí.
Bylo také zjištěno, že senescentní buňky vylučují specifickou sadu molekul, která způsobuje senescenci u sousedních buněk. Tento princip zdá se platí i naopak, aktivita prodlužující životnost zaměřená na jednu tkáň může zpomalit stárnutí i v jiných tkáních.
Pokusy ukázaly, že umělým přidáním i velmi malého množství senescentních buněk způsobí zrychlení procesu stárnutí. A naopak odstraněním senescentních buněk vedlo k pozdějšímu nástupu nemocí souvisejících s věkem.
Vyčerpání kmenových buněk
Velká většina buněk v organismu má specifickou funkci. Avšak na začátku vývoje organismu, ve fázi embrya, jsou téměř všechny buňky stejné. Jedná se o takzvané kmenové buňky, které ještě nepřijaly svou funkci a mohou se potenciálně stát jakoukoli částí organismu. Jak plod roste, buňky se množí, diferencují a přebírají svou vhodnou funkci v rámci organismu. U dospělých jsou kmenové buňky převážně umístěny v oblastech, které se opotřebovávají (střevo, plíce, sliznice, kůže) nebo potřebují neustálou obnovu (červené krvinky, imunitní buňky, spermie, vlasové folikuly).
Ztráta regenerační schopnosti je jedním z nejzřetelnějších následků stárnutí. To je většinou způsobeno tím, že se podíl kmenových buněk a rychlost jejich dělení se postupně snižuje. Omlazení kmenových buněk může zvrátit některé důsledky stárnutí na úrovní celého organismu.
Změna mezibuněčné komunikace
Aby celý organismus mohl fungovat, potřebují jednotlivé tkáně a buňky koordinovat svou práci. Jedním z hlavních způsobů, jak komunikují mezi sebou, je vylučování signálních molekul do krve, kde putují do jiných tkání a ovlivňují jejich chování. Profil těchto signálních molekul se s věkem mění.
Jednou z nejvýraznějších změn v signalizaci souvisejících s pokročilým věkem je vývoj chronického slabého zánětu po celém těle. Primární funkcí zánětu je nasměrovat imunitní systém těla a opravné mechanismy do konkrétní poškozené oblasti na tak dlouho, jak dlouho je poškození a hrozba přítomny. Trvalá přítomnost signálů zánětu po celém těle vyčerpává imunitní systém a poškozuje zdravou tkáň.

3 znaky stárnutí přidané v roce 2023
Dysbióza
Lidské tělo je obýváno obrovským množstvím mikroorganizmů, které jsou pro jeho funkci nezbytné. Celému společenství těchto mikroorganismů se říká mikrobiom. Dysbióza je narušení rovnováhy v mikrobiomu, nejčastěji se mluví o střevech, avšak může se jednat o narušení rovnováhy i na jiných místech kde žijí kolonie mikroorganismů, jako například na kůži či v ústech.
Při stárnutí dochází ke změně složení mikroorganismů ve střevě - některých druhů ubývá, některých přibývá, může se snižovat diverzita. Jedním z primárních důsledků je snižující se schopnost organismu regulovat záněty, což vede k vývoji slabého chronického zánětu. U lidí těšících se dobrému zdraví i ve vysokém věku je pozorována mimořádná schopnost střevních bakterií efektivně vyvažovat pro- a protizánětlivé funkce.
Vypínání makroautofagie
Makroautofagie je proces, kterým tělo recykluje nepotřebné struktury. Jedná se zejména o různě velké organely či proteiny, které byly poškozeny, jsou nepoužívány či vznikly po řízeném buněčném zániku (apoptóze). Kromě různých částí buňky pomáhá makroautofagie při likvidaci patogenních mikroorganismů a zároveň je jedním z klíčových procesů pro udržení stabilního vnitřního prostředí v buňkách.
V nouzových situacích, kdy buňky trpí nedostatkem surovin či energie, zvyšuje organismus úroveň makroautofagie aby mohl rozkladem méně používaných proteinů získat potřebné zdroje. Tento stres může mít řadu příčin - například vysoká či nízká teplota, fyzická zátěž, či omezení přijímání potravy.
S věkem klesá aktivita tohoto procesu - je k dispozici méně proteinů a dalších struktur, které autofagii provádějí. Snížena úroveň makroautofagie vede k tomu, že ne všechny přebytečné struktury mohou být zpracovány, a vede ke vzniku řady nemocí souvisejících se stářím.
Chronický zánět
Zánět je schopnost reakce živých organismů na různá poškození. V místě poškození začne tělo vylučovat chemické látky, které přilákají z krve fagocytální buňky. Ty pak začnou pohlcovat patogeny a zbytky buněk. Následuje uzdravení tkáně, které urychluje mírně zvýšená teplota.
Záněty rozdělujeme podle délky trvání na akutní - nejdéle dva týdny, odezní bez následků a chronické - trvají déle než šest týdnů.
Během stárnutí dochází k významným změnám ve fungování imunitního systému. Adaptivní imunitní odpověď ztrácí na efektivitě, jelikož se stárnutím dochází ke snižování počtu lymfocytů a větší úlohu zaujímají paměťové T-lymfocyty na úkor nových (naivních) T-lymfocytů.
Zatímco efektivita adaptivní imunity klesá, přirozená imunita se stává aktivnější. S věkem dochází k vyšší produkci zánětlivých cytokinů. Produkce těchto cytokinů způsobuje chronickou aktivaci buněk přirozené imunity a tím pádem i vznik chronického zánětu ve stáří. Tento jev dostal jméno inflammaging. Inflammaging je charakterizován jako mírný, chronický a asymptomatický zánět, ke kterému dochází při absenci infekce a který je stimulován především molekulami vlastních buněk.
Toto chronické zánětlivé prostředí má škodlivý dopad na zdravotní stav a přispívá k biologickému stárnutí. Inflammaging také může uspíšit nástup a zhoršit průběh řady nemocí souvisejících se stářím.
Chcete rozumět stárnutí více?
Přečtěte si knihu Konec stárnutí.
Zdroje
López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (2013-06-06). "The Hallmarks of Aging". Cell. 153 (6): 1194–1217. doi:10.1016/j.cell.2013.05.039. ISSN 0092-8674. PMC 3836174. PMID 23746838.
López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. Hallmarks of aging: An expanding universe. Cell. 2023 Jan 19;186(2):243-278. doi: 10.1016/j.cell.2022.11.001. Epub 2023 Jan 3. PMID: 36599349.
Hoeijmakers, Jan H.J. (2009-10-08). "DNA Damage, Aging, and Cancer". New England Journal of Medicine. 361 (15): 1475–1485. doi:10.1056/NEJMra0804615. ISSN 0028-4793. PMID 19812404.
Haigis, Marcia C.; Sinclair, David A. (2010-01-01). "Mammalian Sirtuins: Biological Insights and Disease Relevance". Annual Review of Pathology: Mechanisms of Disease. 5 (1): 253–295. doi:10.1146/annurev.pathol.4.110807.092250. ISSN 1553-4006. PMC 2866163. PMID 20078221.
Sanada F, Taniyama Y, Muratsu J, Otsu R, Shimizu H, Rakugi H, Morishita R. Source of Chronic Inflammation in Aging. Front Cardiovasc Med. 2018 Feb 22;5:12. doi: 10.3389/fcvm.2018.00012. PMID: 29564335; PMCID: PMC5850851.
Aman, Y., Schmauck-Medina, T., Hansen, M. et al. Autophagy in healthy aging and disease. Nat Aging 1, 634–650 (2021). https://doi.org/10.1038/s43587-021-00098-4
Badal, V.D.; Vaccariello, E.D.; Murray, E.R.; Yu, K.E.; Knight, R.; Jeste, D.V.; Nguyen, T.T. The Gut Microbiome, Aging, and Longevity: A Systematic Review. Nutrients 2020, 12, 3759. https://doi.org/10.3390/nu12123759
Fontana, L.; Partridge, L.; Longo, V. D. (2010-04-16). "Extending Healthy Life Span--From Yeast to Humans". Science. 328 (5976): 321–326. Bibcode:2010Sci...328..321F. doi:10.1126/science.1172539. ISSN 0036-8075. PMC 3607354. PMID 20395504.
Jordan J. Baechle, Nan Chen, Priya Makhijani, Shawn Winer, David Furman, Daniel A. Winer,
Chronic inflammation and the hallmarks of aging, Molecular Metabolism, Volume 74, 2023, 101755, ISSN 2212-8778, https://doi.org/10.1016/j.molmet.2023.101755.

